2020版《中国药典》今日开始实施
7月2日,国家药品监督管理局、国家卫生健康委发布公告,正式颁布2020年版《中华人民共和国药典》(以下简称《药典》),并于今日实施。新版《药典》共收载品种5911种,新增319种,修订3177种,不再收载10种,品种调整合并4种。穿山甲、马兜铃、天仙藤、黄连羊肝丸等未被继续收载。

《中国药典》是由国家药典委员会创作的,用于保证药品质量可控、确保人民用药安全有效的药品法典。作为国家药品标准体系的核心,药典涵盖了基本药物、医疗保险目录品种和临床常用药品,其设置使得药品研制、生产、经营、使用和管理各环节实现了有法可依、有法必依,严格的法定依据也加强了对药品安全性和有效性的控制。
新版《药典》的实施将对整体提升我国药品标准水平,提高药品质量,保证公众用药安全有效,促进医药产业高质量发展发挥重要作用。
2020年版药典编制工作基本达到了编制大纲设立的各项既定目标:
第一,适度增加了收载品种,收载总数达到5911种,稳步提高了药典收载的品种数量;
第二,基本完成了国家药品标准清理工作,其中涉及化学药6263个品种、中成药9585个品种、饮片药材1252个品种、中药提取物9个品种、生物制品373个品种,为完善标准提高和淘汰机制奠定了坚实的基础;
第三,以实施“两法两条例”为契机,全面、系统地完善了药典的标准体系,贯彻了药品质量全程管理理念,提高了横向覆盖中药、化学药、生物制品、原料药、药用辅料、药包材以及标准物质的质量控制技术规范、要求,完善了纵向涵盖药典凡例、制剂通则、检验方法以及指导原则的制修订,加强了涉及药品研发、生产、质控、流通和使用等环节的通用技术要求体系的建设;
第四,强化了《中国药典》的规范性,使药典各部之间更加的协调、统一。建立并完善了统一规范的药品、药用辅料以及药包材通用名称命名原则,加强了通用技术要求与品种标准内容的统一;
第五,加强药典通用技术要求,重点完善了药品安全性和有效性的控制要求,实现了“中药标准继续主导国际标准制定,化学药、药用辅料标准基本达到或接近国际标准水平,生物制品标准紧跟科技发展前沿,与国际先进水平基本保持一致”的总目标;
第六,加强了药典机构间的国际交流与合作,促进了与药典的协调统一,扩大了《中国药典》的国际影响力。
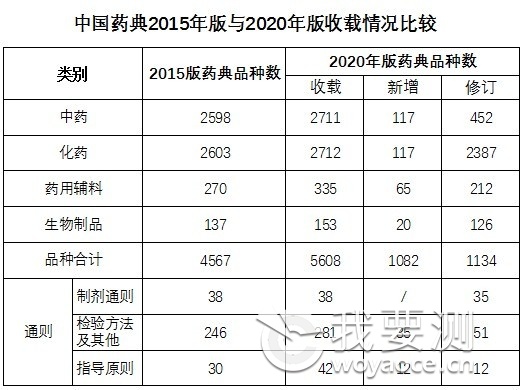
新版药典新增319种,修订3177种,不再收载10种,品种调整合并4种,共收载品种5911种。一部中药收载2711种,其中新增117种、修订452种。二部化学药收载2712种,其中新增117种、修订2387种。三部生物制品收载153种,其中新增20种、修订126种;新增生物制品通则2个、总论4个。四部收载通用技术要求361个,其中制剂通则38个(修订35个)、检测方法及其他通则281个(新增35个、修订51个)、指导原则42个(新增12个、修订12个);药用辅料收载335种,其中新增65种、修订212种(见表1 )
表1 中国药典2020年版收载情况比较
新版药典的特点
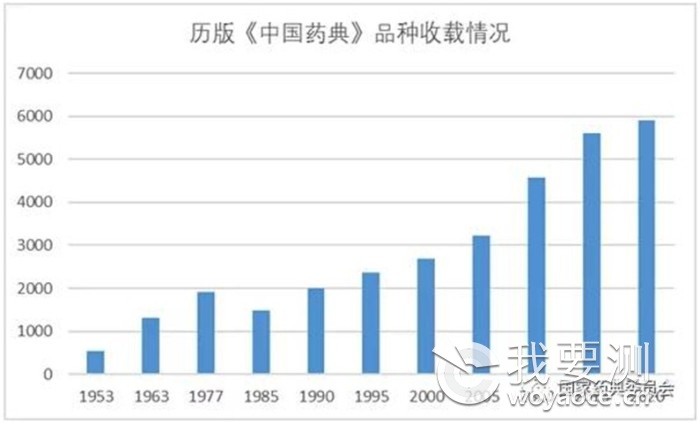
1.稳步推进药典品种收载
与5.5%。品种收载坚持以临床需求为导向,进一步扩大了国家基本药物目录和国家基本医疗保险用药目录品种的收载,使临床常用药品的质量得到了可靠保障。
表2 1953-2020年版《中国药典》收载品种数量情况表
2.药典标准体系进一步完善
2020年版药典编制工作以建立科学、全面、可检验、能执行的标准体系为重点,构建并完善了以凡例为基本要求、通则为总体规定、指导原则为技术引导、品种正文为具体要求的药典架构,不断健全以《中国药典》为核心的国家药品标准体系。同时,通过加强对药典相关通用技术要求和正文具体内容的制修订,从整体上提升了我国药品的标准水平,推进了我国上市药品质量的进一步提升。
3.成熟分析检测技术应用进一步扩大
新版药典对标国际,紧跟国际前沿,借鉴国际先进标准经验,不断扩大成熟检测技术在药品质量控制中的应用,进一步提高检测方法的灵敏度、专属性、适用性和可靠性,对加强药品质量控制,保障药品质量,提升药品监管能力发挥了重要作用。
4.药品安全性控制要求不断加强
在中药方面:加强对中药材(饮片)33种禁用农残的控制,加强对中药材(饮片)真菌毒素、中药内源性毒性成分药材的质量控制,完善了《中药有害残留物限量制定指导原则》。
在化学药方面:加强药品杂质控制,对可能引入基因毒性杂质部分产品在生产要求项目之下增订工艺的评估要求,重点加强高风险制剂涉及安全性控制项目的要求,修订并规范了相关品种无菌和微生物限度要求。
在生物制品方面:加强了对病毒安全性控制,新增氢氧化铝佐剂质量控制通则提升了疫苗佐剂质量,明确了原液合批、防腐剂及抗生素使用的相关原则,增订重组生物技术产品相关蛋白杂质的控制和限度。
5.药品有效性控制不断完善
在中药方面:建立了显微检查法、薄层色谱法、高效液相色谱法、聚合酶链式反应(PCR)法以及核酸序列检测法等一系列中药材(饮片)鉴别方法;基于研究建立了与临床疗效相关的成分含量控制;以质量为标的制定成分限量标准;建立专属性高的指标成分控制项目。
在化学药方面:完善药品制剂的有效性指标项目,进一步完善口服固体制剂溶出度检测方法,加强与放射性药品活性相关的检查方法的研究和增订。
在生物制品方面:增订了人用聚乙二醇化重组蛋白及多肽制品、螨变应原制品和人用基因治疗制品总论等,重组类治疗生物制品增订了相关蛋白检测及限度要求等。
6.全过程质量控制体系逐步构建
进一步加强了涉及药品研发、生产、检测、运输、包装、贮藏等可能影响药品质量环节的相关指导原则的制定,逐步构建全过程质量控制体系。完善了灭菌工艺验证、环境检测等相关技术要求,修订了非无菌药品微生物限度标准、药品洁净实验室微生物监测和控制指导原则、无菌检查用隔离系统验证指导原则、药品微生物实验室质量管理指导原则。
通过对注射剂生产过程中无菌保障体系的评估与调查,增订了灭菌用生物指示剂指导原则、生物指示剂耐受性检查法指导原则,并系统修订了灭菌法,明确企业对控制生产过程中的微生物污染承担主体责任。对制剂通则整体框架进行较系统的增修订,为控制和保证制剂生产的”,特别明确了”要求,以体现制剂全过程控制的理念;提出了”概念,引导药品生产企业根据产品自身稳定性进行前瞻性的质量考察;对”的体例及内容进行了统一,即按照:原辅料工艺与技术质量与控制包装与使用贮存与运输等五个方面的技术要点做出规范,对相关剂型增订了工艺控制技术要求。
7.辅料标准水平进一步提升
进一步增加制剂生产常用药用辅料标准的收载,贯彻原辅包关联审评审批制度质量控制理念,不断健全药用辅料国家标准体系,加强药用辅料自身安全性控制,基于辅料杂质或自身降解产物可能对制剂安全性和稳定性产生的影响,建立相应的控制项目和限度标准,完善辅料相关功能性控制项目的设立、评价方法的建立以及限度标准的制定。
8.国际标准协调进一步加强
加强与国外药典的比对研究,注重国际成熟技术标准的借鉴和转化,不断推进与各国药典标准的协调。参考人用药品注册技术要求国际协调会(ICH相关指导原则在《中国药典》的转化实施。
9.药典导向作用进一步强化
紧跟国际药品标准发展的趋势,兼顾我国药品生产的实际状况,在药品监管理念、质量控制要求、检测技术应用、工艺过程控制、产品研发指导等方面不断加强。在检测项目和限度标准设置方面,既考虑保障药品安全的底线,又充分关注临床用药的可及性,进一步强化药典对药品质量控制的导向作用。
河北省中药材检测中心各中心逐步完成体系改版工作,力争为客户提供药典换版无缝衔接。我们秉承“数字本草”的职业精神,坚持 所以精准“公正、科学、准确、满意、改进的质量方针,构建第三方检测服务平台,为客户提供客观公正、准确高效的全程化、一站式检验服务,从田间地头、仓储物流到医院药房等各环节的全产业链科研定制与检验检测服务,以追溯全程化、检验可视化、信息数字化的质量检测服务市场,提升客户价值。
参考资料:
1、国家药监局 国家卫生健康委关于发布2020年版《中华人民共和国药典》的公告(2020年 第78号)——国家药品监督管理局
2、刚刚!新版药典正式公布,影响所有中药企业——赛柏蓝
3、正式颁布!2020年版《中国药典》来了,12月30日起正式实施——中国医药报
4、2020版《中国药典》正式颁布!12月30日起实施!——搜狐新闻
5、2020年版《中华人民共和国药典》,来了!——腾讯新闻-基源医学在线